Синдром сухого глаза и мигрень
Синдром сухого глаза (ССГ) и мигрень – широко распространенные заболевания в популяции, особенно среди молодых и работоспособных пациентов, поэтому они имеют важное социальное и экономическое значение. Исследования последних лет демонстрируют, что имеется возможная патофизиологическая связь между этими состояниями.
The International Headache Society (IHS) (Международное общество головной боли) определяет мигрень как «повторяющиеся приступы головной боли продолжительностью 4–72 часа»1. Для мигрени характерны односторонние локальные пульсирующие боли, которые также могут сопровождаться тошнотой, фотофобией и / или фонофобией. Приступы мигрени могут быть с аурой или без нее. При мигрени с аурой отмечаются обратимые продромальные симптомы, такие как зрительные, сенсорные или другие нарушения центральной нервной системы продолжительностью несколько минут. Мигрень также подразделяют на хроническую и эпизодическую.
Хроническая мигрень – это приступы головной боли ≥15 дней в месяц в течение трех месяцев, которые, по крайней мере, восемь дней в месяц, имеют особенности мигрени, а эпизодическая мигрень имеет суммарную длительность менее 15 дней в месяц. Как и ССГ, симптомы мигрени значительно снижают качество жизни пациентов2. Так, исследование 80600 пациентов с ≥4 эпизодов головной боли в месяц показало, что они имеют более низкое качество жизни и ухудшение работоспособности по сравнению с пациентами, не страдающими головной болью3.
Интересно, что более низкая оценка качества жизни среди пациентов с мигренью тесно связана с присутствием симптомов ССГ.
Исследование в Корее: 14329 участников, данные получены с помощью опросников.
Частота диагноза ССГ оказалась выше у пациентов с мигренью:
об эпизодах мигрени;
и 8,2% без мигрени, р <0,0001;
и 15,1% без мигрени, р <0,0001;
Авторы пришли к выводу, что мигрень увеличивает вероятность диагноза ССГ в 1,58 раза4.
Исследование «случай-контроль» среди пациентов стационаров Университета Северной Каролины: 72969 участников, случаи с диагнозами ССГ и мигрень идентифицировались по соответствующим кодам МКБ-9 и МКБ-10, – у пациентов с мигренью чаще встречался ССГ.
Среди пациентов с мигренью у 19,6% присутствовал ССГ, без мигрени – у 12,7%. Наличие мигрени увеличивало вероятность диагноза ССГ в 1,42 раза, причем связь была самой сильной среди женщин ≥65 лет5.
В других исследованиях изучалась обратная связь: вероятность мигрени у людей с ССГ.
Исследование в Тайвани с использованием кодов МКБ-9 (n = 48028): наличие диагноза ССГ увеличивает вероятность мигрени в 1,76 раза6.
В нескольких исследованиях, посвященных изучению ССГ у пациентов с мигренью, выявлены следующие особенности: как правило, при мигрени отмечаются более выраженные субъективные симптомы ССГ (оценка по опроснику OSDI), в то время как объективные клинические признаки ССГ – время разрыва слезной пленки (ВРСП), тест Ширмера и окрашивание эпителия роговицы – не имеют значимых различий у пациентов с наличием мигрени и без нее7. Среди субъективных симптомов светобоязнь встречается часто и характерна для обоих заболеваний.
Изучаются нейронные пути, лежащие в основе фотофобии как при ССГ8, так и мигрени9.
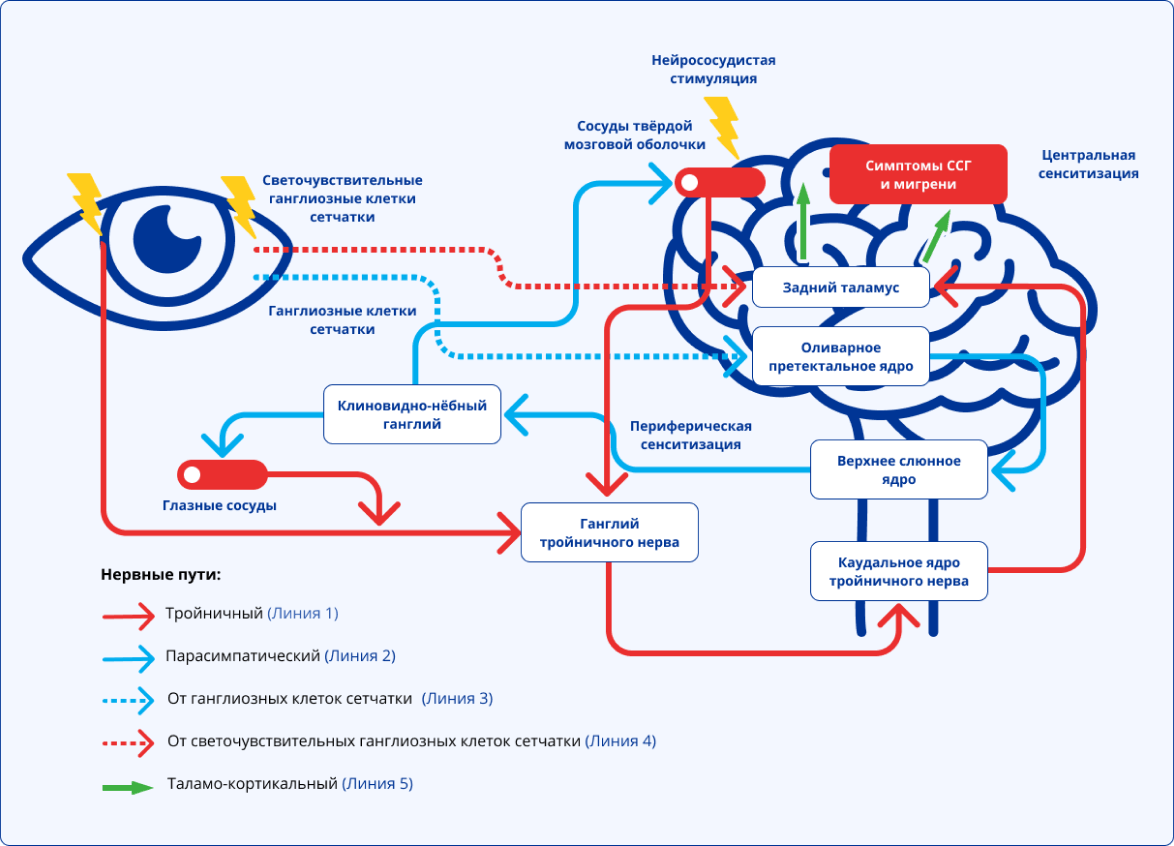
Рис. 1. Основные нейронные звенья патогенеза фотофобии при синдроме сухого глаза и мигрени. Свет индуцирует сигналы от клеток палочек и колбочек, которые передаются через амакринные и биполярные клетки (не показано) к ганглиозным клеткам сетчатки и затем проецируются в оливарное претектальное ядро (Линия 3). Линия 2: парасимпатические сигналы проходят от оливарного претектального ядра к верхнему слюнному ядру, затем в клиновидно-небный ганглий, а также глазные сосуды и сосуды твердой мозговой оболочки для обеспечения расширения сосудов. Линия 1: афферентные сигналы тройничного нерва от роговицы (стимулируемые повреждениями роговицы), глазных сосудов и сосудов твердой мозговой оболочки (стимулируемые вазодилатацией) идут к ганглию тройничного нерва, а затем к каудальному ядру тройничного нерва и, наконец, к заднему таламусу. В качестве альтернативы, вызванные светом сигналы от светочувствительных ганглиозных клеток проходят непосредственно в задний таламус (Линия 4). Линия 5: сигналы от заднего таламуса направляются в соматосенсорную и зрительную часть коры головного мозга и передают сигналы о симптомах ССГ и мигрени10.
Одна из теорий патофизиологической связи между ними: симптомы ССГ и мигрень связаны с аномальной периферической активацией тройничного нерва с последующей периферической и центральной сенситизацией. Периферическая сенситизация определяется как «повышенная возбудимость и снижение порога чувствительности ноцицептивных нейронов на периферии к стимуляции их рецептивных полей»11. Центральная сенситизация – это «повышенная чувствительность ноцицептивных нейронов центральной нервной системы к их нормальному или подпороговому афферентному входу»11. Также обсуждаются изменения вторичных и третичных нервов, которые соединяют афференты роговицы с расположенными выше областями коры.
Аномалии периферических нервов при ССГ и мигрени
В ряде работ предполагается, что как симптомы ССГ, так и головная боль при мигрени возникают из-за периферической сенситизации12,13. При ССГ активация и изменения периферической НС могут быть следствием ряда причин, в том числе хронической эпителиопатии, высокой осмолярности слезы, воспаления глазной поверхности и / или повреждения нерва в результате хирургического вмешательства (например, рефракционная хирургия)12.
Изменения в структуре и функции роговичных нервов также были выявлены в нескольких исследованиях пациентов с ССГ по сравнению с контролем. Большинство авторов сообщают о снижении плотности и чувствительности роговичных нервов у пациентов с дефицитом водного компонента слезной пленки и синдромом Шегрена, но не при синдроме сухого глаза с увеличением испарения14.
С другой стороны, факторы, приводящие к патологии периферических нервов при мигрени по-прежнему остаются предметом дискуссии. В нескольких небольших исследованиях в Китае15 и Индии16 было показано, что у пациентов с мигренью присутствуют структурные изменения роговичных нервов (меньше ветвление и извитость нервных волокон) по сравнению с контролем, а также у пациентов с фотофобией отмечалась меньшая длина роговичных нервных волокон. Также было обнаружено, что у пациентов с мигренью повышена чувствительность роговицы.
Аномалии в центральной нервной системе при ССГ и мигрени
Учёные предполагают, что симптомы как ССГ, так и мигрени частично вызваны центральной сенситизацией за счет повышения активности в ядрах тройничного нерва. При этом важную роль в этом процессе играют медиаторы воспаления. Так, было показано, что Calcitonin gene-related peptide (CGRP), нейропептид, участвующий в нейрогенном воспалении, а также в работе сердечно-сосудистой, желудочно-кишечной и эндокринной систем8, ассоциирован также с изменениями функции нервов при ССГ и мигрени. В исследовании на крысах после индуцированного повреждения роговицы гептанолом концентрация CGRP значительно возрастала в периферических роговичных нервах, а также в тройничном ганглии17. И аналогично в экспериментальной модели мигрени на животных концентрация CGRP повышалась в ядрах тройничного нерва18. При этом известно, что CGRP также связан и с мигренью у людей: P.J. Goadsby et al.открыли, что CGRP – единственный нейропептид, уровень которого повышается при мигрени19, а Hansen et al. обнаружили, что внутривенное введение CGRP пациентам с мигренью вызывает приступы головной боли20. Исследования моноклональных антител к CGRP, блокирующих действие CGRP, показали, что их применение значительно уменьшает симптомы мигрени. Появились новые препараты (фреманезумаб, галканезумаб и эптинезумаб), которые представляют собой моноклональные антитела к CRGP или его рецептору21. Они доказали свою высокую эффективность как при эпизодической, так и при хронической мигрени22.
Интересно также, что активность воспаления влияет на чувствительность роговичных нервов при ССГ. В Турции обследовали пациентов с объективными признаками ССГ до применения циклоспорина 0,05% и после и обнаружили, что чувствительность роговицы снижается после применения циклоспорина23.
Таким образом, развитие ССГ и мигрени связано с множеством потенциальных триггерных факторов и сопровождается процессами воспаления и нейронными аномалиями как периферическими, так и центральными.
Диагностика ССГ и мигрени
Возможное сочетание ССГ и мигрени важно для диагностики и лечения пациентов с данными состояниями (Рисунок 2). Офтальмологам важно учитывать наличие сопутствующих заболеваний и эпизоды головной боли у пациентов с ССГ, а неврологам обращать внимание на ССГ у пациентов с мигренью и давать соответствующие рекомендации.
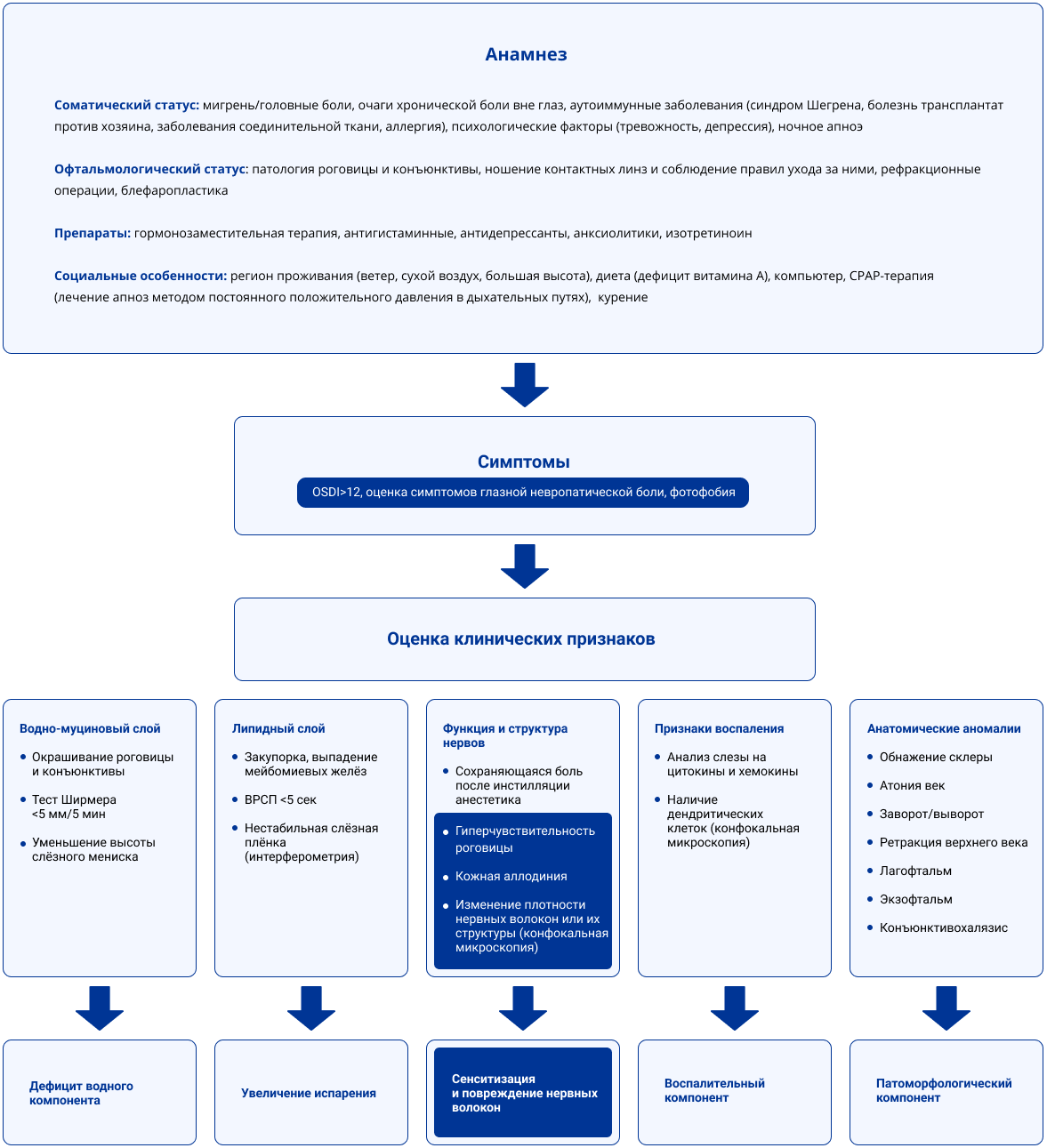
Рис. 2. Клиническая оценка пациентов с синдромом сухого глаза. Синим цветом выделены особенности, которые могут быть общими при ССГ и мигрени17.
Эффективность терапии мигрени в лечении ССГ
Как правило, основная цель лечения ССГ – устранить патологические изменения глазной поверхности и улучшить состояние слезной пленки. Если этого недостаточно для устранения симптомов ССГ, следует также сделать акцент на неврологическое лечение. Методы лечения мигрени могут быть полезными и при ССГ.
Так, пациентам с признаками боли, опосредованной ЦНС (периокулярная аллодиния на легкое прикосновение, фотофобия, непрекращающаяся боль после анестезии), целесообразно назначить системные нейромодуляторы. Существуют пероральные нейромодуляторы, эффективные для профилактики мигрени, в частности, ингибиторы обратного захвата серотонина и норадреналина и трициклические антидепрессанты (ТЦА)2, а также для купирования острого приступа мигрени, например, триптаны24. Учитывая общие патофизиологические механизмы мигрени и ССГ, пациенты с ССГ также могут почувствовать облегчение при применении пероральных нейромодуляторов. И действительно, был отмечен выраженный эффект купирования боли при применении габапентина и прегабалина у пациентов с ССГ и выраженным болевым синдромом, резистентным к местной терапии25. В другом исследовании применяли нортриптиллин (ТЦА) в течение 4 недель и более и получили уменьшение глазного болевого синдрома, устойчивого к другим видам терапии и анестезии, а также повышение оценки качества жизни пациентов26.
Таким образом, у пациентов с симптомами ССГ и клиническими признаками, указывающими на аномалии ЦНС, пероральные нейромодуляторы могут облегчить симптомы глазной боли. Однако для пациентов с ССГ или мигренью, у которых отсутствует или недостаточен ответ на пероральную терапию, можно рассмотреть также и адъювантную терапию.
Адъювантная терапия часто применяется при мигрени и может также быть эффективна при лечении ССГ. Например, ботулинический токсин, давно применяющийся и доказанно эффективный при мигрени27, был также исследован для лечения ССГ. Предполагается, что ботулотоксин устраняет боль за счет того, что уменьшает сокращения лицевых мышц и, таким образом, ослабляет афферентный сигнал тройничного нерва, а также снижает синаптическое высвобождение CGRP28. В Южной Флориде обследовали 117 пациентов с хронической мигренью, им вводили ботулинический токсин А (среднее количество введенных единиц: 114,4 ± 24,5), у пациентов уменьшились не только боли при мигрени , но и светобоязнь и субъективные симптомы ССГ29. Этот эффект не зависел от показателей слезной пленки28, поэтому можно предположить, что существуют механизмы развития симптомов, независимые от имеющихся нарушений слезопродукции. При этом, 4 человека с симптомами ССГ без мигрени, (введение ботулинического токсина А 35 единиц в 7 местах) отмечали улучшение состояния и уменьшение светобоязни через 1 месяц после инъекции30. Эти данные позволяют сделать вывод, что ботулотоксин А может уменьшить фотофобию и симптомы ССГ у людей как с мигренью, так и без нее.
Также в ряде исследований с хорошим эффектом применялись блокады нервов у пациентов с рефрактерными симптомами ССГ и хроническим болевым синдромом (часто триггером болевого синдрома в этих случаях было предшествующее хирургическое вмешательство)25.
Заключение
Исследования последних лет свидетельствуют о наличии возможной связи между мигренью и ССГ. Эта информация важна для понимания патофизиологических механизмов и разработки методов лечения как мигрени, так и болевого синдрома при ССГ. Повреждение нейронов, периферическая и центральная сенситизации на уровне тройничных путей могут быть важными механизмами развития симптомов ССГ у некоторых пациентов. Клинически это может проявляться гипералгезией (например, боль как реакция на ветер), фотофобией и расширением рецептивного поля (боль на легкое прикосновение к коже вокруг глаз). Поэтому целесообразен неврологический скрининг пациентов с ССГ, и у некоторых пациентов с ССГ также может быть эффективна неврологическая терапия.
Мнение экспертов

Бржеский Владимир Всеволодович
Доктор медицинских наук, заведующий кафедрой офтальмологии ФГБОУ ВО СПбГПМУ Минздрава России. Представитель TFOS* в России

Голубев Сергей Юрьевич
Старший научный сотрудник, Институт медико-биологических проблем РАН, ИМБП РАН, Москва. Представитель TFOS* в России
Эксперты проекта отвечают на вопросы участников:
Наблюдаете ли вы связь неврологических заболеваний и ССГ?
Безусловно, такая связь существует. Любая неврологическая патология, сопровождающаяся нарушением иннервации роговицы, конъюнктивы, слезных желез и др., оказывает влияние на функционирование так называемого слезного комплекса. При этом снижение чувствительной и/или трофической иннервации сопровождается уменьшением числа мигательных движений, снижением клиренса слезной жидкости в конъюнктивальной полости и, наконец, продукции компонентов слезной пленки.
Напротив, интенсивная болевая импульсация от раздраженной на фоне ССГ роговицы и конъюнктивы способствует формированию на глазной поверхности триггерной зоны и сенсибилизации чувствительных рецепторов глазной поверхности.
В силу изложенных обстоятельств, связь неврологической патологии с ССГ существует и она двусторонняя. Важно отметить, что лечение таких пациентов наиболее оптимально проводить в тесном сотрудничестве и деятельном взаимодействии неврологов и офтальмологов.
Неврологические симптомы у пациентов с ССГ: на что обратить внимание офтальмологу
- На наличие нарушений эпителия роговицы (явления «точечной» кератопатии, наличие микроэрозий роговицы). Они могут быть триггерными зонами для интенсивной неврологической симптоматики. В указанных целях целесообразно воспользоваться витальными красителями (флюоресцеин-натрия и др.).
- На снижение стабильности слезной пленки: её выраженное снижение с формированием «сухих» пятен, которое также может вызывать выраженную болевую симптоматику.
- На инъекцию сосудов лимба и конъюнктивы, свидетельствующую о наличии воспалительного процесса ксеротического генеза. Подобная клиническая картина может быть ассиметрична.
Неврологическое лечение в терапии ССГ:
Безусловно, комплексный подход к больным с ССГ, осложненным неврологической симптоматикой, необходим: он должен включать и местную терапию, направленную на компенсацию ССГ, и лечебные мероприятия неврологической направленности, призванные купировать избыточную неврологическую симптоматику. Такое лечение в нашей клинической практике обычно назначает невропатолог.
Учитывая определенное своеобразие клинической картины и субъективной оценки проявлений ССГ неврологическими больными, мы отдаем предпочтение слезозаменителям, способным не только стабилизировать слезную пленку, но и обеспечивать длительный зрительный комфорт. Капли на основе гидроксипропилгуара обеспечивают так называемый трансформационный эффект, объединяя комфорт при использовании и длительное увлажнение.
Систейн – линейка увлажняющих капель с трансформационным эффектом1
Во флаконе и при закапывании низкая вязкость, что позволяет легко и комфортно использовать капли2
На поверхности глаза вязкость повышается
пропорционально степени тяжести ССГ
для продолжительной защиты и увлажнения3,4

1. Benelli U. Systane lubricant eye drops in the management of ocular dryness. Clin Ophthalmol. 2011. 2. Ketelson HA et al. Characterization of a novel polymeric artificial tear delivery system Invest Ophthalmol Vis Sci.2008; 49:
ИНФОРМАЦИЯ ПРЕДНАЗНАЧЕНА ДЛЯ МЕДИЦИНСКИХ И ФАРМАЦЕВТИЧЕСКИХ РАБОТНИКОВ
Ссылки
- Headache Classification Committee of the International Headache Society (IHS). The international classification of headache disorders, 3rd edition. Cephalalgia. 2018;38(1):1–211. doi:10.1177/ 0333102417738202
- Burch RC, Buse DC, Lipton RB. Migraine: epidemiology, Burden, and Comorbidity. Neurol Clin. 2019;37(4):631–649. doi:10.1016/j.ncl.2019.06.001
- Vo P, Fang J, Bilitou A, Laflamme AK, Gupta S. Patients’ perspective on the burden of migraine in Europe: a cross- sectional analysis of survey data in France, Germany, Italy, Spain, and the United Kingdom. J Headache Pain. 2018;19. doi:10.1186/s10194-018-0907-6
- Yang S, Kim W, Kim HS, Na KS. Association between migraine and dry eye disease: a nationwide population-based study. Curr Eye Res. 2017;42(6):837–841. doi:10.1080/02713683.2016.1262876
- Ismail OM, Poole ZB, Bierly SL, et al. Association between dry eye disease and migraine headaches in a large population-based study. JAMA Ophthalmol. 2019;137(5):532–536. doi:10.1001/ jamaophthalmol.2019.0170
- Wang TJ, Wang IJ, Hu CC, Lin HC. Comorbidities of dry eye disease: a nationwide population-based study. Acta Ophthalmol. 2012;90(7):663–668. doi:10.1111/j.1755-3768.2010.01993.x
- Farhangi M, Diel RJ, Buse DC, et al. Individuals with migraine have a different dry eye symptom profile than individuals without migraine. Br J Ophthalmol. 2020;104(2):260–264. doi:10.1136/ bjophthalmol-2018-313471
- Diel RJ, Mehra D, Kardon R, Buse DC, Moulton E, Galor A. Photophobia: shared pathophysiology underlying dry eye disease, migraine and traumatic brain injury leading to central neuroplasticity of the trigeminothalamic pathway. Br J Ophthalmol. 2020; bjophthalmol-2020-316417.
- Brennan KC, Pietrobon D, A systems neuroscience approach to migraine. Neuron. 2018;97(5):1004–1021. doi:10.1016/j.neuron. 2018.01.029
- Baksh BS, Garcia JC, Galor A. Exploring the Link Between Dry Eye and Migraine: From Eye to Brain. Eye Brain. 2021;13:41-57 https://doi.org/10.2147/EB.S234073
- IASP terminology; 2018. Available from: http://www.iasp-pain. org/terminology. Accessed February 22, 2021.
- Galor A, Moein H-R, Lee C, et al. Neuropathic pain and dry eye. Ocul Surf. 2018;16:31–44. doi:10.1016/j.jtos.2017.10.00168.
- Burstein R, Noseda R, Borsook D. Migraine: multiple processes, complex pathophysiology. J Neurosci. 2015;35(17):6619–6629. doi:10.1523/JNEUROSCI.0373-15.2015
- Patel S, Hwang J, Mehra D, Galor A. Corneal nerve abnormalities in ocular and systemic diseases. Exp Eye Res. 2020;202:108284. doi:10.1016/j.exer.2020.108284
- Shen F, Dong X, Zhou X, Yan L, Wan Q. Corneal subbasal nerve plexus changes in patients with episodic migraine: an in vivo confocal microscopy study. J Pain Res. 2019;12:1489–1495. doi:10.2147/JPR.S196705
- Shetty R, Deshmukh R, Shroff R, Dedhiya C, Jayadev C. Subbasal nerve plexus changes in chronic migraine. Cornea. 2018;37(1):72–75. doi:10.1097/ICO.0000000000001403
- Hegarty DM, Hermes SM, Morgan MM, Aicher SA. Acute hyperalgesia and delayed dry eye after corneal abrasion injury. Pain Rep. 2018;3(4):e664–e664. doi:10.1097/PR9.000000000 0000664
- Zhang Y, Zhang Y, Tian K, et al. Calcitonin gene-related peptide facilitates sensitization of the vestibular nucleus in a rat model of chronic migraine. J Headache Pain. 2020;21(1):72. doi:10.1186/ s10194-020-01145-y
- Goadsby P.J., Reuter J., Hallstrom Y., et al. A controlled trial of erenumab for episodic migraine. N Engl J Med 2017; 377: 2123–2132.
- Hansen J.M., Hauge A.W., Olesen J., Ashina M. Calcitonin gene- related peptide triggers migraine- like attacks in patients with migraine with aura. Cephalalgia 30, 1179–1186 (2010).
- Edvinsson L., Haanes K.A., Warfvinge K., et al. CGRP as the target of new migraine therapies – successful translation from bench to clinic. Nat Rev Neurol. 2018; 14(6): 338–350.
- Urits I, Jones MR, Gress K, et al. CGRP antagonists for the treatment of chronic migraines: a comprehensive review. Curr Pain Headache Rep. 2019;23(5):29. doi:10.1007/s11916-019-07 68-y
- Toker E, Asfuroglu E. Corneal and conjunctival sensitivity in patients with dry eye: the effect of topical cyclosporine therapy. Cornea. 2010;29(2):133–140. doi:10.1097/ICO.0b013e3181acf 68d
- Konstantinos S, Vikelis M, Rapoport A. Acute care and treatment of migraine. J Neuro Ophthalmol. 2020;40(4):472–484. doi:10.10 97/WNO.0000000000001053
- Small LR, Galor A, Felix ER, Horn DB, Levitt RC, Sarantopoulos CD. Oral gabapentinoids and nerve blocks for the treatment of chronic ocular pain. Eye Contact Lens. 2020;46 (3):174–181. doi:10.1097/ICL.0000000000000630
- Ozmen MC, Dieckmann G, Cox SM, et al. Efficacy and tolerability of nortriptyline in the management of neuropathic corneal pain. Ocul Surf. 2020;18(4):814–820. doi:10.1016/j.jtos.2020.08.006
- Herd CP, Tomlinson CL, Rick C, et al. Cochrane systematic review and meta-analysis of botulinum toxin for the prevention of migraine. BMJ Open. 2019;9(7):e027953. doi:10.1136/bmjopen-2018-027953
- Diel RJ, Hwang J, Kroeger ZA, et al. Photophobia and sensations of dryness in migraine patients occur independent of baseline tear volume and improve following botulinum toxin A injections. Br J Ophthalmol. 2019;103(8):1024–1029. doi:10.1136/bjophthalmol-2018-312649
- Diel RJ, Kroeger ZA, Levitt RC, et al. Botulinum toxin A for the treatment of photophobia and dry eye. Ophthalmology. 2018;125 (1):139–140. doi:10.1016/j.ophtha.2017.09.031
- Venkateswaran N, Hwang J, Rong AJ, et al. Periorbital botulinum toxin A improves photophobia and sensations of dryness in patients without migraine: case series of four patients. Am J Ophthalmol Case Rep. 2020;19:100809. doi:10.1016/j.ajoc.2020.100809
Материалы Клуба PROфессионалов предназначены только для медицинских работников. Если вы являетесь медицинским работником, то для регистрации вам необходимо перейти в личный кабинет и заполнить данные о специалисте
Материалы предназначены только для медицинских работников
Данный раздел сайта содержит информацию, предназначенную только для медицинских и фармацевтических работников.
Вы являетесь медицинским или фармацевтическим работником?
